
Verbale num. 10
 |
EQUILIBRIO TERMICO: esperimento
2
Consegne:
Prepara due campioni di acqua (uno di massa M1=50
g e l'altro M2=100g) a temperature diverse.
Misura accuratamente la temperatura dei due campioni.
T1 = temperatura CAMPIONE 1 ……….°C
T2 = temperatura CAMPIONE 2 ……….°C
Fai una previsione sulla temperatura che otterrai
mescolando i due campioni
Previsione: T= temperatura del CAMPIONE somma
= ……….°C
Mescola i due campioni e misura la temperatura
finale
Misura sperimentale: T= temperatura del CAMPIONE
somma = ……….°C
Il risultato sperimentale conferma la tua previsione?
Se la tua previsione è errata rifletti
e formula nuove ipotesi.
Se la tua previsione è esatta:
1) spiega che calcoli hai effettuato per trovarla
2) esprimili con una espressione
T=………….
3) spiega quale ragionamento ti ha portato a
formulare questa ipotesi
(usa il retro del foglio e lascia anche le eventuali
ipotesi sbagliate)
Ogni gruppo ha discusso, fatto ipotesi e sperimentato
e al termine abbiamo confrontato i risultati.
Riflessioni
1)
la situazione dell'esperimento precedente
|

|
corrisponde a:
|
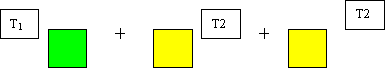
|
Che si può risolvere con la media di tre masse uguali:
T = (T1+T2+T2) / 3 = (T1+2*T2) / (1+2)
Confrontiamo con i nostri dati sperimentali:
|
|
T1 (°C)
|
T2 (°C)
|
T sperimentale
|
T teorica
|
differenza
|
|
8
|
61
|
28
|
25,7
|
2,3
|
|
9
|
64
|
29
|
27,3
|
1,7
|
|
8
|
6,5
|
27
|
27
|
0
|
|
8,7
|
66,5
|
27,6
|
28
|
-0,4
|
|
8
|
68,3
|
27,8
|
28,1
|
-0,3
|
|
8
|
61
|
26
|
25,7
|
0,3
|
|

I risultati sperimentali vanno molto d'accordo per 4 gruppi un po'
meno per i primi due, ma le differenze di circa due gradi potrebbero derivare
dalla scarsa precisione delle misure.
2) Proviamo
a ipotizzare che cosa succederebbe con due masse una due terzi dell'altra
|
T1   + +   T2 T2
|
che possiamo trasformare in:
|
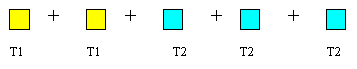
|
Che si può risolvere con la media di tre masse uguali:
T = (T1+ T1+T2+ T2+T2) / 5 = (2*T1+3*T2) / (2+3)
3) per due
quantità a caso si può rappresentare ogni grammo con un quadratino
e allora la formula diventa:
T = (m1*T1+ m2*T2) / (m1+m2)
EQUILIBRIO TERMICO: esperimento
3
Da dove siamo partiti
Se mescoliamo due liquidi diversi a temperatura diversa, possiamo usare
le formule che abbiamo utilizzato mescolando l'acqua?
Che cosa abbiamo fatto
Abbiamo provato a mescolare:
|
a)
Masse uguali di latte a temperatura diverse:
|
T2 (°C)
|
T1(°C)
|
Tsperimentale
|
(T1+T2)/2
|
differenza
|
|
12
|
64
|
38
|
38
|
0
|
|

|
b)
Masse uguali di detersivo liquido a temperatura diverse:
|
T2(°C)
|
T1(°C)
|
Tsperimentale
|
(T1+T2)/2
|
differenza
|
|
19
|
61
|
40
|
40
|
0
|
La media funziona quando i liquidi
sono uguali
|

|
c)
Masse uguali di acqua e latte a temperatura diverse:
|
T2(°C)
|
T1(°C)
|
Tsperimentale
|
(T1+T2)/2
|
differenza
|
|
10
|
66
|
37,5
|
38
|
0,5
|
|
10
|
59
|
33
|
34,5
|
1,5
|
C'è un po' di differenza tra
temperatura sperimentale e teorica:
- Errori sperimentali?
- La formula non funziona, ma si vede poco
perché il latte è molto simile all'acqua?
|

|
d)
Masse uguali di acqua e detersivo liquido a temperatura diverse:
|
T2(°C)
|
T1(°C)
|
Tsperimentale
|
(T1+T2)/2
|
differenza
|
|
13,6
|
64,2
|
47
|
38,9
|
8,1
|
|
8
|
61
|
28
|
23,7
|
4,3
|
|

|
e)
Masse uguali di acqua e olio per motori a temperatura diverse:
|
T2(°C)
|
T1(°C)
|
Tsperimentale
|
(T1+T2)/2
|
differenza
|
|
10,2
|
63
|
44
|
36,6
|
7,4
|
|

Negli ultimi due casi c'è differenza
tra la temperatura sperimentale e quella teorica
Che cosa abbiamo imparato
1. Se i due
liquidi che mescoliamo sono uguali, possiamo trovare la temperatura finale
calcolando la media delle due temperature iniziali: il calore viene ripartito
nello stesso modo tra le due parti che si mescolano.
2. Se i due
liquidi che mescoliamo sono diversi, non possiamo trovare la temperatura
finale calcolando la media delle due temperature iniziali: è come
se uno dei due liquidi avesse bisogno di più/meno calore dell'altro
per scaldarsi e quindi la temperatura finale è più bassa/alta
della media; questa cosa è ragionevole perché nell'esperimento
del 27 marzo abbiamo visto che ogni sostanza ha il suo calore specifico.
|

Laboratorio di scienze "Freddo o Caldo" - Silvia Contarini,
Annalisa Salomone
 |


